| Grafito | ||
|---|---|---|
 |
||
| General | ||
| Categoría | Minerales elementos nativos | |
| Clase | 1.CB.05a (Strunz) | |
| Fórmula química | C | |
| Propiedades físicas | ||
| Color | Negro acero y gris | |
| Raya | Negra | |
| Lustre | metálica, tierra | |
| Transparencia | no | |
| Sistema cristalino | Hexagonal (6/m 2/m 2/m) | |
| Hábito cristalino | Tabular, de seis caras foliada, las masas granulares compactados | |
| Exfoliación | Perfecto en una dirección | |
| Fractura | Escamosa, de lo contrario en bruto, cuando no en la división | |
| Dureza | 1-2 (Mohs) | |
| Tenacidad | Escamas finas flexibles y quebradizas | |
| Densidad | 2,09 a 2,23 g/cm³ | |
| Índice de refracción | Opaco | |
| Pleocroísmo | No | |
| Solubilidad | Fundido Ni | |
| Magnetismo | diamagnético | |
| [editar datos en Wikidata] | ||
Fue nombrado por Abraham Gottlob Werner en el año 1789. El término grafito deriva del griego γραφειν (graphein) que significa "escribir", ya que se usa principalmente para crear la punta de los lápices. También se denomina plombagina y plomo negro.
Puede extraerse de yacimientos naturales, pero también se produce artificialmente. El principal productor mundial de grafito es China, seguido de India y Brasil.
Índice
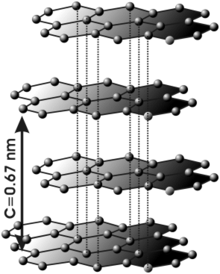
Estructura
Estructura atómica del grafito.
Se podría decir que el grafito está constituido por capas de grafeno superpuestas.
Esta estructura laminar hace que el grafito sea un material marcadamente anisótropo.
Al igual que el diamante, el grafito está constituido exclusivamente por átomos de carbono, pero con una estructura cristalina particular. Tanto el grafito como el diamante son formas alotrópicas del carbono, de entre las múltiples que son posibles. El grafito, como el diamante, es un mineral semimetálico. Se conocen procesos mediante los cuales el grafito puede convertirse en diamante mediante el uso de muy elevadas presiones y temperaturas, pero esos métodos son de un coste superior al valor de mercado de los diamantes que se obtendrían, por lo que el hecho apenas se ha aprovechado comercialmente excepto para fabricar microdiamantes empleados en herramientas especiales.
Propiedades
El grafito es de color negro con brillo metálico, refractario y se exfolia con facilidad. En la dirección perpendicular a las capas presenta una conductividad de la electricidad baja, que aumenta con la temperatura, comportándose pues como un semiconductor. A lo largo de las capas la conductividad es mayor y aumenta proporcionalmente a la temperatura, comportándose como un conductor semimetálico. Aunque tanto el grafito como el diamante están formados exclusivamente por átomos de carbono, el grafito es muy blando y opaco, mientras que el diamante es el mineral más duro según la escala de Mohs y además deja pasar la luz a través de sí. Estas marcadas diferencias físicas se deben exclusivamente a las diferentes redes cristalinas o retículos sobre las que se disponen los átomos de carbono en el grafito (átomos de carbono en los vértices de prismas hexagonales) y en el diamante (la red cristalina está hecha de tetraedros regulares cuyos vértices son átomos de carbono).Aplicaciones
- El grafito mezclado con una pasta se utiliza para fabricar la mina de los lápices.
- Se usa como componente de ladrillos, crisoles, etc.
- Al deslizarse las capas fácilmente en el grafito, resulta ser un buen lubricante sólido.
- Se utiliza en la fabricación de diversas piezas en ingeniería, como pistones, juntas, arandelas, rodamientos, etc.
- Debido a su conductividad eléctrica se usa para fabricar electrodos. También tiene otras aplicaciones eléctricas, como los carbones de un motor (escobillas), que entran en contacto con el colector.
- Se emplea en reactores nucleares, como moderadores y reflectores.
- Es usado para crear discos de grafito parecidos a los de discos vinilo salvo por su mayor resistencia a movimientos bruscos de las agujas lectoras.
- Se puede crear grafeno, material de alta conductividad eléctrica y térmica, futuro sustituto del silicio en la fabricación de chips.
- Se emplea en la fabricación de carretes y cañas de pesca.
Compuestos de intercalación de grafito
Distintas moléculas o iones pueden penetrar en las capas del grafito. Por ejemplo el potasio puede ceder un electrón al grafito, quedando el ion de potasio, K, entre las capas. Este electrón contribuye a aumentar la conductividad que presentaba el carbono.Se pueden preparar diferentes compuestos de intercalación con distintas estequiometrías y distintas especies. En algunos casos la conductividad resultante es mayor, como en el caso del potasio, y es lo que ocurre generalmente, pero en otros, como por ejemplo con flúor, es menor.
Otras formas relacionadas
Existen otras formas llamadas de carbón amorfo que tienen una estructura relacionada con la del grafito:Referencias
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Grafito.
Wikimedia Commons alberga contenido multimedia sobre Grafito. Wikcionario tiene definiciones y otra información sobre grafito.
Wikcionario tiene definiciones y otra información sobre grafito.- El Grafito.
- The Graphite Page (en inglés).
- Web con mucha información sobre el grafito.
- Carbón.

No hay comentarios:
Publicar un comentario
Procura comentar con libertad y con respeto. Este blog es gratuito, no hacemos publicidad y está puesto totalmente a vuestra disposición. Pero pedimos todo el respeto del mundo a todo el mundo. Gracias.